Meio de indol
Princípio:
É utilizado para diferenciar gêneros e espécies de enterobactérias.
Determina a habilidade do microrganismo de metabolizar o triptofano em indol. Triptofano é um aminoácido que pode ser oxidado por certas bactérias resultando na produção de indol, após a adição de reagentes de Erlich ou Kovacs.
Fórmula:
| Triptona | 1 g |
| Água destilada | 100 mL |
Preparo:
Pesar e colocar em balão já contendo a metade da água, homogeneizar e acrescentar o restante da água, agitar até completa dissolução. Em seguida distribuir 2 mL em tubos 12 mm x 75 mm, fechar cada tubo com rolha de algodão hidrófobo, autoclavar a 120° C por 15 minutos.
Conservação e validade:
Conservar embalado de 4 a 8°C por até 3 meses.
Inoculação:
Utilizar colônia pura de 18 a 24 horas;
Fazer um inóculo denso;
Pingar 2 gotas do inóculo ou, com uma alça bacteriológica flambada e resfriada, inocular diretamente a bactéria no caldo.
Incubar a 35°C de 18 a 24 horas
Controle de qualidade:
Positivo: Escherichia coli ATCC 25922.
Negativo:Klebsiella pneumoniae ATCC 13883.
Interpretação:
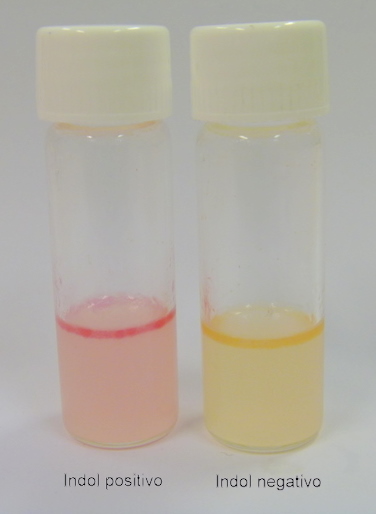
Cor original do meio: amarelo pálido
Após a incubação adicionar 5 gotas ou até formar um anel, do reativo de Kovacs (Paradimetilaminobenzaldeído 50mg/mL) pela parede do tubo com crescimento bacteriológico, fazer a leitura.
Positivo: formação de um anel cor-de-rosa na superfície do meio.
Negativo: há acúmulo de reativo amarelo na superfície do meio.
1- Reativo de Kovacs para Prova de Indol
Fórmula:
| Paradimetilaminobenzaldeído | 10 g |
| Álcool amílico ou isoamílico | 150 mL |
| Ácido clorídrico concentrado | 50 mL |
Preparo:
Dissolver o aldeído no álcool e adicionar lentamente o ácido clorídrico, homogeneizar e armazenar em frasco âmbar na geladeira.
A coloração do meio fica vermelha. Deixar em repouso por cerca de 6 a 7 horas antes do uso, após este período a cor passará para amarelo, só então estará pronto para uso.


