Meio de Rugai & Araújo modificado por Pessoa & Silva ou meio IAL
Atualmente conhecido como IAL (Meio Instituto Adolfo Lutz) foi inicialmente proposto por Rugai & Araújo, em 1986, com a intenção de eliminar as falhas existentes nos meios similares, até então usados.
Em 1972, Pessoa & Silva, desenvolveram um meio que possibilitou a pesquisa da motilidade e da descarboxilação da lisina, concomitantemente com as reações obtidas no meio clássico de Rugai & Araújo.
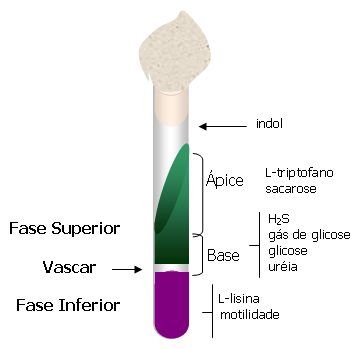
Este meio é utilizado para identificar as principais espécies de Enterobactérias, Víbrios e Aeromonas, permitindo em um só tubo a leitura, das seguintes reações: motilidade da bactéria indicado pela turvação da lisina na base, lisina descarboxilase, fermentação da glicose em profundidade e da sacarose na superfície do meio, produção de gás sulfídrico (H2S), gás em glicose, utilização do aminoácido L-triptofano (desaminação), hidrólise da uréia e no tampão do tubo, um desenvolvimento de coloração avermelhada que indica a formação de indol.
O meio IAL é constituído por duas fases, superior e inferior, separadas por uma camada intermediária, chamada vascar, de cerca de 2 mm.
1 - Fase Intermediária (Vascar)
Fórmula:
| Vaselina líquida | 90 mL |
| Cera de carnaúba | 10 g |
Preparo:
Pesar a cera e adicionar a vaselina em um copo de Becker e aquecer com agitação constante até completa fusão da cera e o aparecimento de uma mistura líquida homogênea. Tomando cuidado para não ocorrer o superaquecimento (repetir este procedimento de aquecimento toda vez que for usar o vascar). O vascar é armazenado em um recipiente de boca larga, rotulado em geladeira.
Distribuir cerca de 0,2 mL de vascar em tubos 12 mm x 120 mm antes de colocar a fase inferior do meio.
2 - Fase Inferior
Fase semi-sólida permite observar a descarboxilação da lisina e a mobilidade da bactéria. Após preparo, o meio apresenta coloração lilás.
Fórmula:
| Extrato de levedura | 1,2 g |
| Dextrose | 0,2 g |
| Nitrato de potássio | 0,2 g |
| L-Lisina | 2 g |
| Ágar ágar | 1,6 g |
| Solução alcoólica de púrpura de bromocresol à 0,2% | 4 mL |
| Água destilada | 400 mL |
| pH final = 6,4 | |
Preparo:
Pesar todos os reagentes individualmente e adicionar a um balão com a água sem o ágar. Homogeneizar e verificar o pH 6,4.
Juntar o ágar-ágar, e aquecer levemente sob constante agitação até a completa dissolução do ágar. Distribuir 2 mL nos tubos de vidro 12 mm x 120 mm, já contendo o vascar.
Fechar cada tubo com rolhas de algodão hidrófilo (branco), colocá-los na posição vertical, embalar, rotular e autoclavar a 120° C por 15 minutos.
Após autoclavação, deixar solidificar em posição vertical a temperatura ambiente.
O vascar forma um anel sobre a fase inferior, só assim ele estará pronto para receber a fase superior assepticamente.
3 - Hidróxido de sódio (NaOH) 1N
Fórmula:
| Hidróxido de sódio | 0,4 g |
| Água destilada | 100mL |
Preparo:
Armazenar em frasco âmbar a temperatura ambiente.
4 - Solução alcoólica de púrpura de bromocresol a 0,2%
Fórmula:
| Hidróxido de sódio 1N | 1mL |
| Púrpura de bromocresol | 0,2g |
| Álcool etílico | 63mL |
| Água destilada | 49mL |
Preparo:
Adicionar 1mL da solução de hidróxido de sódio 1N à água e esperar 30 minutos para estabilizar. Após 30 minutos acrescentar a púrpura e o álcool, homogeneizar até a completa dissolução.
Armazenar em frasco âmbar à temperatura ambiente. Utilizar somente após 48 horas.
5 - Solução de substratos
Fórmula:
| Citrato de ferro amoniacal | 2 g |
| Tiossulfato de sódio | 2g |
| Sacarose | 80 g |
| Glicose ou Dextrose | 10 g |
| Uréia | 40 g |
| Água destilada | 85 mL |
Preparo:
Adicionar em um copo de Becker todos os reagentes previamente pesados e a água, em seguida levar ao banho-maria 65º C, para dissolver.
Após a completa dissolução, esterilizar por filtração e distribuir assepticamente em frasco âmbar com tampa de rosca já estéril. Armazenar em geladeira.
6 - Solução alcoólica de azul de bromotimol a 1,5%
Fórmula:
| Azul de bromotimol | 1,5 g |
| Álcool etílico (q.s.p.) | 100mL |
Preparo:
Pesar o azul de bromotimol e adicionar em um copo de Becker com um pouco do álcool para dissolver. Após a completa dissolução, completar com o restante do álcool (q.s.p.) para 100mL.
7 - Fase Superior
Meio sólido, permite observar a utilização da glicose em profundidade com ou sem produção de gás, utilização da sacarose e desaminação de l-triptofano (LTD), no ápice do meio, produção de H 2S, hidrólise da uréia e a produção de indol na rolha de algodão hidrófilo. Após preparo o meio apresenta coloração verde.
Fórmula:
| Triptona | 4 g |
| Extrato de carne | 0,8 g |
| Cloreto de sódio | 2 g |
| Fosfato dissódico | 0,8 g |
| L – triptofano | 0,4 g |
| Solução alcoólica de azul de bromotimol 1,5% | 0,8 mL |
| Ágar ágar | 4,4 g |
| Água destilada | 400 mL |
| pH final = 6,4 | |
Preparo:
Pesar todos os reagentes um a um e ir adicionando em um balão com a água sem o ágar. Homogeneizar e acertar o pH para 6,4.
Juntar o ágar, aquecer levemente sob constante agitação até a completa dissolução do ágar, evitando o superaquecimento. Tampar com algodão hidrófobo, embalar, identificar e levar a autoclave 120° C por 15 minutos.
Após autoclavação, resfriar à 65° C, adicionar assepticamente 1,75 mL da solução de substrato, para cada 100 mL de meio. Homogeneizar e distribuir assepticamente 2 mL deste meio em tubos de vidro 12 mm x 120 mm, contendo a fase inferior e o vascar já estéril e solidificado.
Colocar os tubos inclinados em ângulo de 45° a temperatura ambiente até solidificar. Após completa solidificação, rotular cada tubo e armazenar na geladeira em recipiente fechado, para que o meio não desidrate.
8 - Reativo de Ehrlich para indol (para teste na rolha de algodão)
Fórmula:
| Paradimetilaminobenzaldeído | 1 g |
| Ácido orto-fosfórico na formula líquida xaroposo | 14 mL |
| Álcool etílico absoluto | 50 mL |
| Água destilada (qsp) | 100 mL |
Preparo:
Em frasco âmbar com tampa esmerilhada, dissolver o aldeído no álcool.
Inoculação
O Meio de IAL deve ser inoculado com fio bacteriológico flambado e resfriado. Se Pega uma colônia a ser pesquisada, e inocula-se em picada (punção) até quase chegar ao final do tubo, cuidando para não mexer a agulha. Ao voltar à superfície semear em estria na superfície inclinada do meio.
Incubar em estufa bacteriológica a 37° C por 18 a 24 horas.
9 - Leitura do meio de IAL
Interpretação
Fase Superior
Ápice:
azul: sacarose negativa LTD negativo
Amarelo: sacarose positiva LTD negativo
verde garrafa: sacarose negativa LTD positivo
castanho: sacarose positiva LTD positivo
Base:
amarelo: glicose positiva
Base: amarelo: glicose positiva
Azul: uréia positiva
Preto: H2S positivo
amarelo com bolhas : glicose e gás positivos
Fase Inferior:
violeta : lisina descarboxilase positiva
Amarelo : lisina descarboxilase negativa
com turvação : motilidade positiva (móvel)
sem turvação : motilidade negativa se observa nitidamente o crescimento
Teste de indol na rolha:
Após a incubação pingar assepticamente, 2 à 3 gotas do reativo de Ehrlich para indol na rolha do algodão hidrófilo.
Indol positivo: algodão fica rosa ou vermelho
Indol negativo: algodão permanece sem cor ou com coloração amarelo.


